

1.Einleitung 2.Grundlagen 3.Adsorptions-Isothermen 4.Mehrkomponenten-Adsorption 5.Aktivkohlefilter
Die graphische Darstellung der Beladbarkeit einer Aktivkohle in Abhängigkeit von der Gleichgewichts-Konzentration bei konstanter Temperatur nennt man Adsorptions-Isotherme. In der Praxis dient diese Darstellung dazu, die Menge an Schadstoffen abzuschätzen, die mit der Aktivkohle gebunden werden kann. Damit ergibt sich dann die Zeit bis der Aktivkohlefilter erschöpft ist und somit auch die anfallenden Kosten.
Die Adsorptions-Isothermen sind grundsätzlich der Gestalt, daß bei höheren Konzentrationen in der Luft oder im Wasser mehr Schadstoff von der Kohle adsorbiert werden kann.
Die adsorbierte Masse an Schadstoffen wird auf die Masse der frischen Aktivkohle bezogen und Beladung genannt. Sie wird in Prozent angegeben:
Beladung = Masse Schadstoff / Masse frischer Aktivkohle * 100 %
Im Allgemeinen haben die Adsorptions-Isothermen folgende Gestalt (Abb. 3):
Diese drei Bereiche gehen fließend in einander über und lassen sich nicht genau abgrenzen.
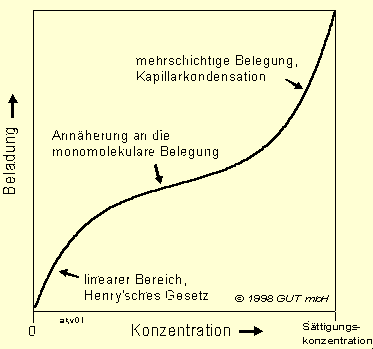
Abb. 3: Allgemeiner Verlauf von Adsorptions-Isothermen
Im Sanierungsbereich hat man es in der Regel mit Schadstoffkonzentrationen zu tun, die viel kleiner sind als die Sättigungskonzentration. Die Sättigungskonzentration in Luft für CKW und BTX liegt bei 20 °C im wesentlichen zwischen 100.000 und 1.000.000 mg/m³ (Tab. 1), bei Sanierungsfällen sind meist Konzentrationen zwischen 0,5 und 5.000 mg/m³ anzutreffen. Somit ist im Sanierungsbereich meist nur der Bereich (1) und (2) bis zur Annäherung an die monomolekulare Belegung relevant. Eine Ausnahme macht lediglich der Wasserdampf (Luftfeuchtigkeit), der eine Konzentration nahe an der Sättigungsgrenze erreichen kann (siehe unten).
Hauptquelle für die im folgende mitgeteilten Adsorptions-Isothermen sind Angaben der verschiedenen Aktivkohlehersteller. Deren Messungen erfolgen aber meist bei relativ hohen Konzentrationen, so daß die Isothermen in den sanierungsrelevanten niedrigen Konzentrationsbereich extrapoliert werden mußten. Im Rahmen dieser Studie wurden jedoch eine Reihe von Isothermen experimentell bei niedrigen Konzentrationen überprüft, so daß die wiedergegebenen Daten gut begründet sind.
Wenn man mit den Adsorptions-Isothermen rechnen möchte, ist es günstig diese mathematisch zu beschreiben. In der Praxis hat sich ergeben, daß in den meisten Fällen eine einfache, empirische Potenzfunktion ausreicht.
q = k * cn
wobei
q = Beladung der Aktivkohle
c = Konzentration des Schadstoffs
k = Konstante
n = Konstante
Diese mathematische Beschreibung wird in der Literatur meist als Freundlich-Gleichung bezeichnet (nach Ostwald, Boedecker und Freundlich 1906). Die Funktion ist in Abb. 4 graphisch dargestellt
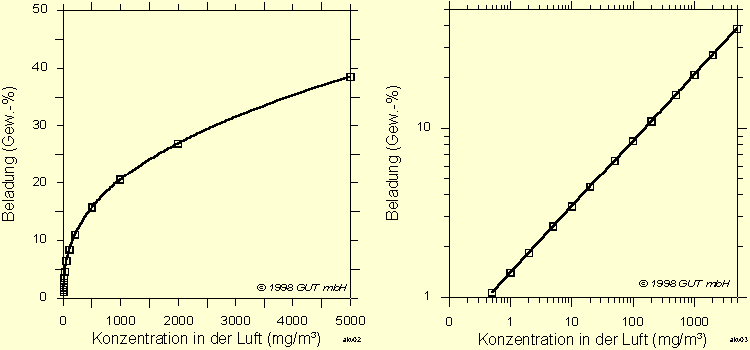
Abb. 4: Typische Gestalt von Adsorptions-Isothermen im sanierungsrelevanten Konzentrationsbereich. Links: lineare Achsenteilung. Rechts: doppeltlogarithmische Achsenteilung
Bei einer Darstellung auf doppeltlogarithmischen Papier ergibt sich eine Gerade. Die Angabe der Konstanten ist nur sinnvoll in Verbindung mit den gewählten Einheiten der Beladung und der Konzentration. Die Konstante k entspricht im Zahlenwert der Beladung bei der Schadstoffkonzentration von 1. Der Exponent n entspricht der Steigung der Geraden bei der doppeltlogarithmischen Darstellung.
Für manche Fällen reicht die Freundlich-Gleichung allerdings nicht zur Beschreibung von Adsorptions-Isothermen aus. Hier können dann die thermodynamisch begründeten Langmuir- oder BET-Gleichungen angewandt werden.
In Abb. 5 sind die Adsorptions-Isothermen für 20 °C warme Luft von ausgewählten CKW und BTX graphisch dargestellt. Man beachte die doch großen Unterschiede in der Beladung bei vorgebener Konzentration. Durch die doppeltlogarithmische Darstellung werden die Unterschiede etwas verschleiert. Soll zum Beispiel Bodenluft mit einer Konzentration von 2 mg/m³ cis 1,2 Dichlorethen mit Aktivkohle gereinigt werden, kann man mit einer Beladung von 0,4 Gew.-% rechnen. Bei einem Xylol-Schaden beläd sich die Aktivkohle immerhin mit etwa 12 Gew.-%. Für die Sanierung des Cis-Schadens braucht man also etwa 30mal soviel Kohle wie für einen Xylol-Schaden.
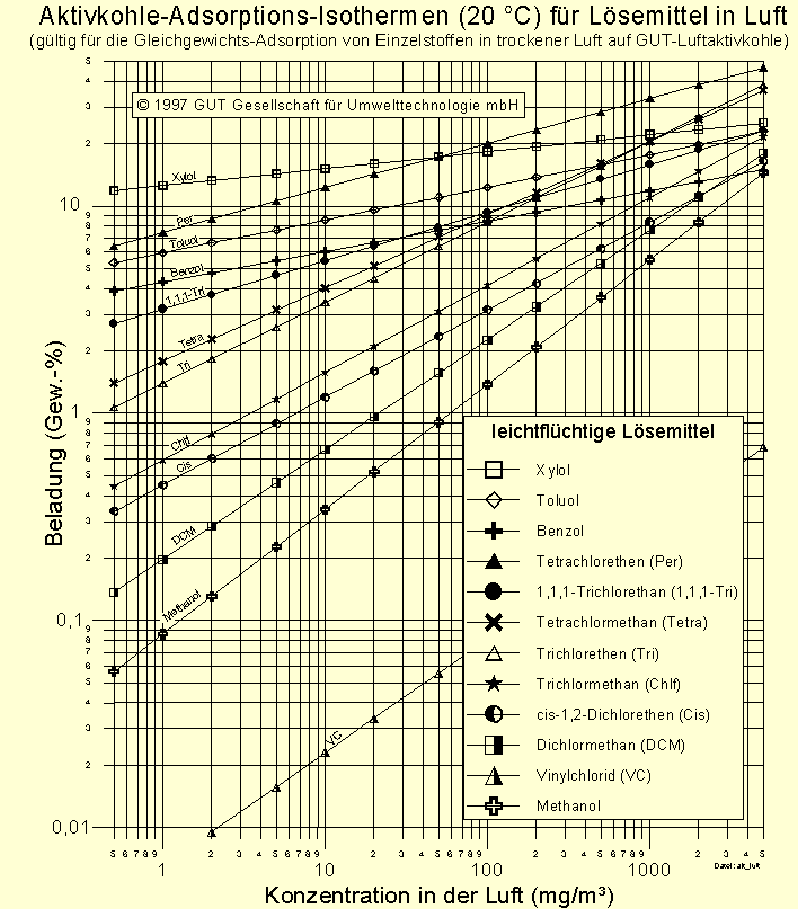
Abb. 5: Adsortions-Isothermen (20 °C) von verschiedenen CKW und BTX.
Wie schon weiter oben aufgezeigt wurde, hängt die Adsorption nicht nur vom jeweiligen Schadstoff sondern von einer ganzen Reihe von Parametern ab. So sind die Isothermen, die in Abb. 5 dargestellt sind, nicht universell anwendbar, sondern können nur beispielhaft genutzt werden. Dies liegt unter anderem daran, daß die Adsorption für jede Aktivkohlesorte unterschiedlich ist. In Abb. 6 sind die Isothermen von Dichlormethan an vier verschiedenen handelsüblichen Aktivkohlesorten dargestellt. Bei gegebener Konzentration muß also bei der erzielbaren Beladung mit deutlichen Unterschieden gerechnet werden (Faktor 2 und mehr).
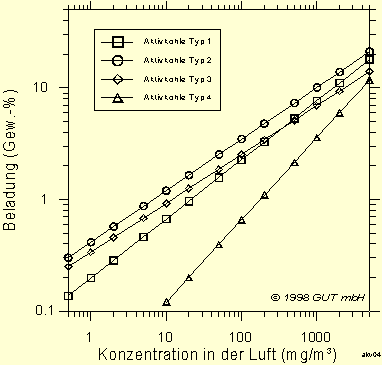
Abb. 6: Adsorptions-Isothermen (20 °C) für Dichlormethan für vier verschiedene Aktivkohlesorten
Die bisher angegebenen Isothermen gelten für 20 °C. Bei niedrigeren Temperaturen adsorbiert die Aktivkohle mehr von dem Schadstoff, bei höherer Temperatur weniger. In Abb. 7 sind die Isothermen von Dichlormethan für 20, 30 und 50 °C dargestellt. Die Abbildung 8 zeigt einen linearen Zusammenhang zwischen der Temperatur und der Beladung mit Butan.
Die Abhängigkeit von der Temperatur ist beträchtlich. Die Schadstoffadsorption sollte bei möglichst geringer Temperatur erfolgen.
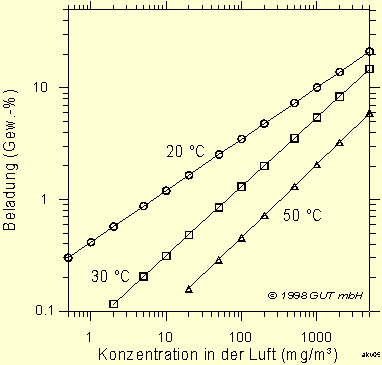
Abb. 7: Adsorptionsisothermen für Dichlormethan
bei verschiedenen Temperaturen
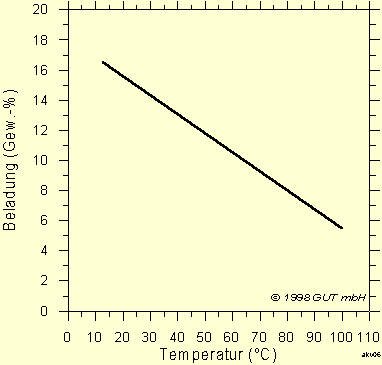
Abb. 8: Einfluß der Temperatur auf die Adsorption
von Butan
(bei einer Konzentration von 24200 mg/m³ in der Luft, nach Lurgi)